Lo studio con dotto dai ricercatori dell’Ospedale di Philadelphia è stato pubblicato sulla rivista Science Immunology
I recettori dell’antigene chimerico (CAR) hanno aperto un nuovo entusiasmante campo di progressi terapeutici per tumori rari e difficili da trattare, poiché hanno la capacità di fornire terapie mirate in grado di uccidere le cellule tumorali.
I CAR peptidi-centrici (PC-CAR) si basano su “codici a barre” specifici dei peptidi; che derivano da proteine all’interno della cellula create da oncogeni potenzialmente cancro, sono progettati per trovare e colpire il cancro celle. Questi “codici a barre” vengono visualizzati dagli antigeni leucocitari umani (HLA), che aiutano il sistema immunitario a distinguere le proprie proteine dagli invasori estranei, come i virus.
Tuttavia, gli HLA derivano dagli HLA più “polimorfici”; geni, con più di 25.000 alleli – tratti di DNA che codificano per proteine che svolgono funzioni essenziali – che potrebbero variare tra loro, rendendo difficile progettare PC-CAR che prendano di mira gli alleli specifici associati a diversi tumori.
Ora, i ricercatori di due laboratori che collaborano strettamente presso l’Ospedale pediatrico di Filadelfia (CHOP) hanno risolto una struttura proteica tridimensionale che spiega come i PC-CAR possono riconoscere le “spine dorsali” delle cellule. di questi complessi HLA. Le informazioni strutturali consentiranno ora ai ricercatori di comprendere come i CAR riconoscono gli antigeni associati al tumore tra diversi alleli HLA polimorfici, aprendo così maggiori possibilità per la progettazione di strategie di medicina di precisione per tumori più complessi e difficili da trattare.
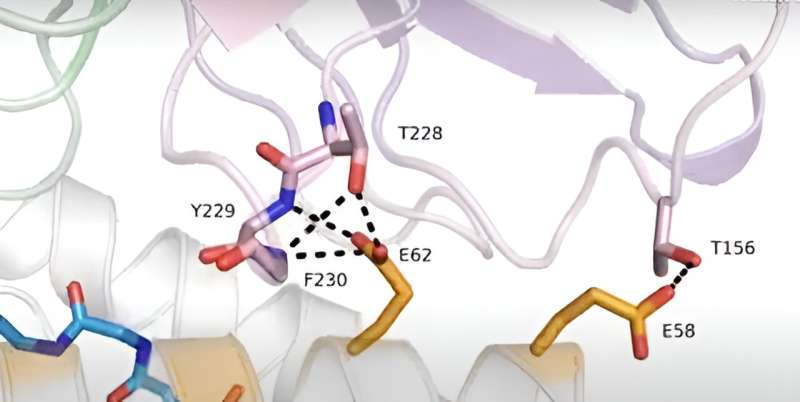
Il filmato inizia mostrando il complesso 10LH CAR: PHOX2B–HLA-A*24:02. Le catene pesanti e leggere del 10LH CAR sono colorate rispettivamente in viola e verde. Il peptide è mostrato come bastoncini blu e l’HLA è colorato in grigio. La struttura viene ruotata di 180° e quindi ingrandisce il prominente filtro di selettività peptidica che collega gli elementi di tutti e tre i componenti del complesso molecolare.
Il residuo HLA chiave (Q72) è mostrato in arancione, il residuo peptidico chiave (R6) in blu e i residui CAR chiave in rosa (D232 – catena pesante) e verde (W88 – catena leggera). I legami idrogeno sono mostrati con linee tratteggiate nere e un’interazione catione-π è mostrata come linea tratteggiata gialla. Il filmato quindi si ingrandisce per mostrare i residui della struttura HLA lungo l’elica a1 dell’HLA.
Si concentra sui legami idrogeno tra questi residui della struttura e i CDR 10LH. Il filmato quindi si ingrandisce nuovamente per mostrare i residui della struttura lungo l’elica a2 dell’HLA. Ancora una volta, i legami idrogeno vengono mostrati quando si ingrandisce contatti specifici. Il film si conclude mostrando nuovamente l’intero complesso.
“Se i CAR non vengono abbinati correttamente per colpire gli alleli specifici associati a determinati tumori, esiste il rischio di indurre tossicità senza fornire alcun beneficio terapeutico”, ha affermato Nikolaos G. Sgourakis, Ph.D., professore associato presso il Centro di medicina computazionale e genomica del CHOP. “Osservando le loro complesse strutture 3D, possiamo utilizzare questi risultati per progettare CAR in grado di colpire più HLA e aumentare l’efficienza della progettazione terapeutica.”
Le terapie CAR precedenti potevano colpire solo gli antigeni specifici del cancro sulla superficie delle cellule tumorali e la maggior parte di questi risiede all’interno delle cellule.
Tuttavia, i ricercatori hanno scoperto che questi obiettivi precedentemente inaccessibili alla fine vengono degradati in peptidi, che possono essere espressi sulla superficie come “codici a barre”; e poi presi di mira dalla terapia. Anche in questo caso, con così tanta variabilità negli alleli dell’HLA, le terapie CAR potrebbero essere in grado di aiutare solo una frazione di pazienti con tumori, a seconda di quali peptidi sono espressi sulla superficie di una cellula tumorale.
Poiché gli HLA hanno più di 25.000 alleli potenzialmente mutati, esaminarli uno per uno per trovare potenziali bersagli e progettare terapie CAR associate è un compito troppo complesso.
In questo studio, tuttavia, i ricercatori hanno utilizzato una combinazione di analisi di legame biochimico, simulazioni di dinamica molecolare e analisi strutturali e funzionali per determinare che alcuni classi di HLA sono cross-reattive, il che significa che diversi antigeni possono essere riconosciuti in modo simile dalla terapia PC-CAR. In altre parole, mentre i “codici a barre” del peptide; può avere una variabilità significativa, la “spina dorsale” di questi HLA è sufficientemente simile da essere riconosciuto da queste terapie.
Questo lavoro è stato svolto da un gruppo di studenti universitari e laureati dell’Università della Pennsylvania e scienziati senior CHOP dello Sgourakis Lab.
CHOP è stato un pioniere nello sviluppo di PC-CAR. Il coautore senior dello studio John M. Maris, MD, oncologo pediatrico e titolare della cattedra Giulio D’Angio per la ricerca sul neuroblastoma presso il CHOP, ha pubblicato contemporaneamente un articolo aggiornato sulla rivista Nature sullo sviluppo e l’efficacia dei PC-CAR e i pazienti vengono attualmente reclutati per studi clinici basati sui loro genotipi HLA per esplorare ulteriormente l’efficacia dei PC-CAR nel trattamento di forme rare e complesse di cancro.
“Affinché qualsiasi terapia con cellule CAR T sia sicura ed efficace, è necessario trovare dei ‘bersagli’ affinché le cellule T trovino il tumore. Le cellule T PC-CAR si concentrano su bersagli molto specifici che si trovano solo sulle cellule tumorali e non sulle cellule sane normali,” Ha detto Maris.
“Questo studio essenzialmente ci fornisce un modello su come integrare le nuove conoscenze sulla biologia strutturale degli HLA e dei PC-CAR in questo entusiasmante campo di nuove opzioni per il trattamento di tumori impegnativi.”